70万一支“天价药” 医保局回应了
发表日期:2020-08-10
据红星新闻报道,广东一位母亲,向国家药监局提交信息公开申请,希望了解70万元一针的诺西那生钠注射液的采购方式和国内定价依据,引发网友的关注和热议。

该份申请书显示,欧阳春兰请求公开引进诺西那生钠注射液的采购合同、国内销售价格定价依据和定价计算相关说明,以及诺西那生钠注射液库存数量和分配发放的信息。
70万一针的诺西那生钠注射液治疗的是什么疾病呢?
据悉,诺西那生钠注射液由渤健公司研发,2016年12月23日首次在美国获批,是全球首个脊髓性肌肉萎缩症精准靶向治疗药物。随后,该药物在欧盟、巴西、日本、韩国、加拿大等国家获得批准用于治疗脊髓性肌肉萎缩症。
2019年4月28日,诺西那生钠注射液在中国上市,用于治疗5qSMA,并成为中国首个能治疗脊髓性肌肉萎缩症的药物。
发病率1/6000-1/10000的婴幼儿遗传病
公开资料显示,脊髓性肌萎缩症(Spinal Muscular Atrophy,SMA)是一种罕见的遗传性神经肌肉疾病,在新生儿中的发病率约为 1/6000-1/10000,又被称为“婴幼儿遗传病杀手”。
根据起病年龄和运动里程的获得情况,SAM分为SMA-I型、II型、III型和IV型,如果不进行治疗,大多数SMA-I型的患儿无法存活到两岁。
之所以称其为罕见病,是因为这种疾病对于绝大多数人都是陌生的。赛柏蓝查询脊髓性肌萎缩症相关论文后发现,2016年的一篇文章指出,国内的SMA病患数量估计在30000人以上。
在不同的国家,因为人口基数等因素的差异,对罕见病的定义也不尽相同。根据2002年美国国会通过的《罕见疾病法》,影响美国20万人以下的任何疾病或状况,或平均每1500人中出现1个病例的疾病可归类为罕见病。
而欧盟针对罕见病的定义,还包括了除发病率以外的其他因素,如“危及生命,或慢性衰弱性疾病,其患病率如此之低,需要共同努力才能攻克的疾病”。
所谓天价,从产业角度如何理解
公开信息显示,诺西那生钠注射液(Spinraza)在美国的治疗费用也相当昂贵,定价为12.5万美元/针,首年需要注射6次,治疗费用约75万美元,第二年的费用降低一半至37.5万美元。
目前,诺西那生钠注射液在国内的售价为每支69.7万元,属于完全自费药物,已创下了中国药品售价的新纪录。
就诺西那生钠注射液的价格问题,8月5日,国家医保局信访办一工作人员表示,诺西那生钠注射液的价格是由药企自行定价,所以该药在每个国家的价格存在一定出入,“除了药物的原材料、研发成本等,药企也会考虑利润问题,加上该药物目前在国内处于市场垄断的情况,价格也一直居高不下。”
国家药监局方面也表示,国家药监局虽然通过优先审评审批程序批准使用此药进口用于治疗,但其并没有药品定价权。
如果从药企的角度看,我们应该如何去理解这一价格呢?
一方面,目前,国内唯一治疗脊髓性肌萎缩症的药物即为诺西那生钠注射液,在诺西那生钠注射液上市之前,这一疾病属于无药可治的情况。
另一方面,新药研发一直被认为是高风险、高收益的活动,业内一般认为,一个新药的研发需要耗时十年,耗资十亿美金。
另外,由于这一药物治疗的还是罕见性疾病,相比于常见的慢性疾病,患病人数非常少,没有足够的患者数量去摊薄成本,无形中也推高了单个患者需要支付的价格。
其实,另外两种治疗SMA的药物,罗氏的Risdiplam和诺华公司旗下的Zolgensma定价也非常惊人。
据共同社消息,Zolgensma在日本的药价为1.6707亿日元(约合人民币1102万元),是日本国内价格最贵的药物。
得益于优先审评审批,进入中国
值得注意的是,虽然接近70万的天价令人望而却步,但是也必须看到,得益于相关部门的一系列努力,新药在国内上市的速度不断加快,至少在目前,针对一些临床急需的新药,用得上的问题,已经解决了。
2017年12月,原国家食药监总局发布《关于鼓励药品创新实行优先审评审批的意见》明确提出,将罕见病纳入优先审评范围。
2018年9月,诺西那生钠注射液作为已在境外上市且临床急需的罕见病治疗新药被国家药监局纳入优先审评审批程序。
2018年10月31日,国家药监局会同国家卫健委发布《临床急需境外新药审评审批工作程序》及申报资料要求,建立专门通道对临床急需境外上市新药审评审批,对罕见病治疗药品和其他境外新药分别承诺在3个月、6个月内审结。
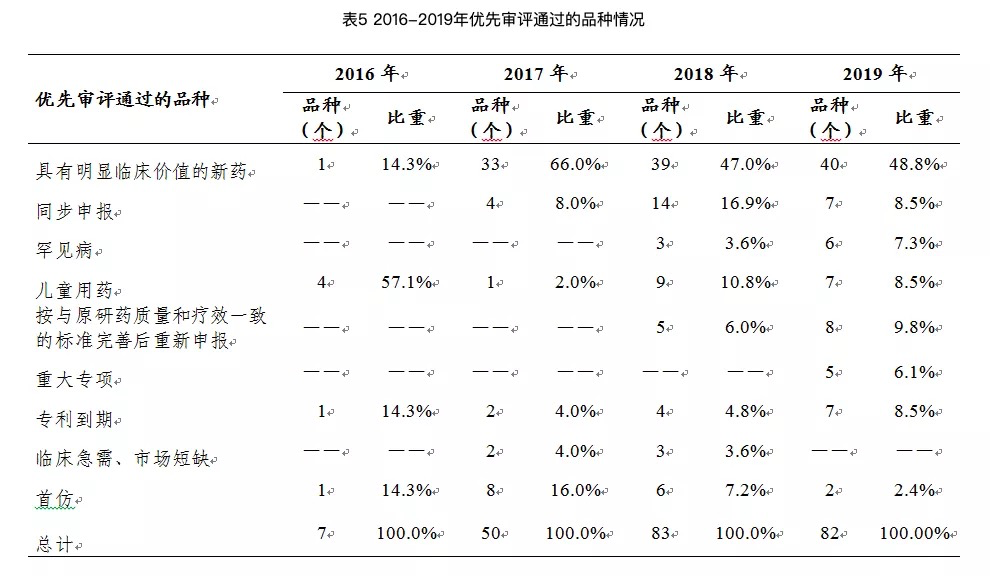
2019年2月,诺西那生钠注射液通过优先审评审批程序在中国获批,2019年4月28日在上海上市。
在日前国家药监局发布的《2019年度药品审评报告》中就出现了诺西那生钠注射液。国家药监局在审评报告中表示,诺西那生钠注射液的上市有效解决了我国脊髓性肌萎缩症目前尚无有效治疗手段的临床用药急需。
2019年,我国药审中心共批准了16个用于治疗罕见病的、临床急需的药品,较2018年增长了60%,且均在规定时限内完成审评工作,大大缩短了临床急需境外新药在我国上市的时间差距。
用得上之后,还希望用得起
在媒体传播的信息中,有一组看似对比鲜明的数字刺痛了部分网友的神经——41澳元和70万人民币。但实际上,这两个数字背后是两个不同的概念。
渤健生物在今日发表的声明中指出,药品价格和药品报销后患者自付费用,是两个完全不同的概念。
据澳大利亚药品福利计划(The Pharmaceutical Benefit Scheme - PBS)网站的公开信息,诺西那生钠注射液已被纳入药品福利计划,药品的政府采购单支价格为11万澳元,患者自付费用为41澳元。41澳元不是诺西那生钠注射液在澳大利亚的药品价格。
截至2020年6月30日,诺西那生钠注射液已在全球50个国家和地区获批,并在40多个国家和地区获得了报销,包括澳大利亚。
在中国,诺西那生钠注射液还不是医保药品。根据国家相关规定,参加2019年国家医保谈判的药品必须是2018年12月31日前获得批准的药品。诺西那生钠注射液于2019年2月获批,不符合参加2019年国家医保谈判的条件,因此并未参加2019年国家医保谈判。
渤健生物表示,针对SMA患者,其已经开展了一些援助捐赠活动——2019年5月31日,中国初级卫生保健基金会宣布SMA患者援助项目正式启动,援助药物由渤健公司捐赠——该项目帮助SMA患者第一年的治疗费用相比全自费节省约2/3,之后每年的治疗费用与全自费相比可节省约一半。
截至目前,全国已有80多位SMA患者在援助项目的帮助下获得了药物治疗。
同时,渤健生物也一直与国家和地方政府相关部门保持积极沟通,呼吁建立多方共付机制,以进一步提升中国SMA患者药物可及性。
在去年的国家医保谈判中,150个药品,最终97个谈判成功并被全部纳入医保目录乙类药品范围。一批认可度高、新上市且临床价值高的药品,如癌症、罕见病、慢性疾病用药以及儿童用药调入目录。
国家医保局方面也表示,后续会探索建立医保目录动态调整机制,综合临床需求、医保基金承受力及企业的价格意愿,再次开展价格谈判,将合适的药品纳入医保目录。
应该说,国家医保谈判,一方面释放了支持创新药的明确信号,另一方面也使得贵族药变平民药,极大减轻了患者的负担。
但是也必须看到,我国人口众多,疾病类型复杂多样,随着人口老龄化的加速,医保基金的支付能力也面临挑战,在有限的盘子之下,判断哪些群体的用药和健康需求应该得到保障,其实并不是一个容易的问题。
上一篇: 医保目录调整在即,利好哪些品种?对药企有何启示?
下一篇: 一批品种有望进入2020版国家医保
热门文章排行
更多>>
- 联合国秘书长呼吁停止歧视自...
- 重庆居民慢性病自我管理组首...
- 医学期刊表现抢眼 我国学术...
- 2010年6个医学相关学科取得...
- 听障和脑瘫抢救性门诊费实现...
- 七部门联合检查 所有医疗机...
- 青岛联动机制智斗非法行医“...
- 湖北重点地方病防治“答卷”...
- 山西6月底前实现城镇医保市...
- 零差价冲击客源 单体药店或...
- 医学类毕业生就业冷热不均
- 医药职专就业:畅通“出口”...
- 上海五年内将对儿科、产科、...
- 硕士去绍兴就业 购房打6折
- 应届毕业生春季招聘进入倒计...
- 学历门槛成了就业拦路虎
- 县级医院发展势头猛 医疗人...
- 首批医疗监督大使给力民营医...
- 全球每年死产婴儿数降幅仅1....
- 卫生信息化发力 公私医院实...







