上半年25个创新药获批!豪森、复星等6大国内药企“先发制人”
发表日期:2020-07-07
今年上半年新冠病毒大流行的加压下,美国FDA在审批创新药方面秀出了靓丽成绩单,先后批准25款创新药物,包括20款新分子实体和5款生物药,涉及多种治疗领域,特别审批通道“多管齐下”,抗体药物地位不菲,中国药企为新药进入中国市场积极铺路。
表1:上半年FDA批准新药信息
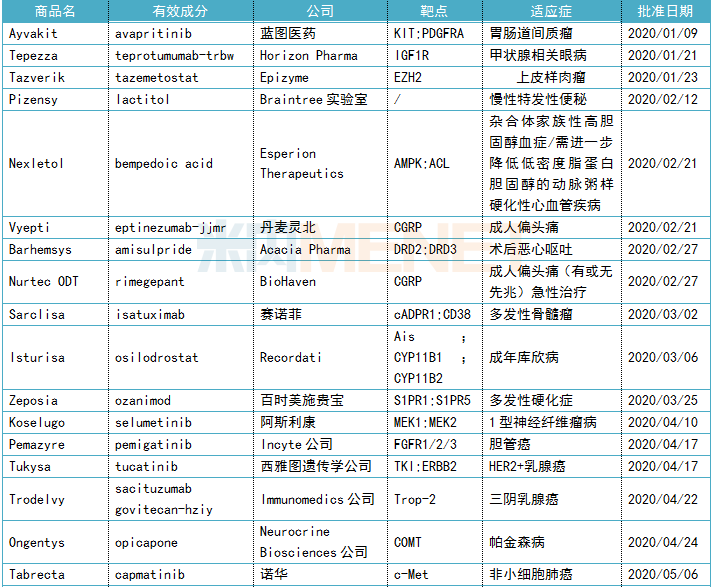
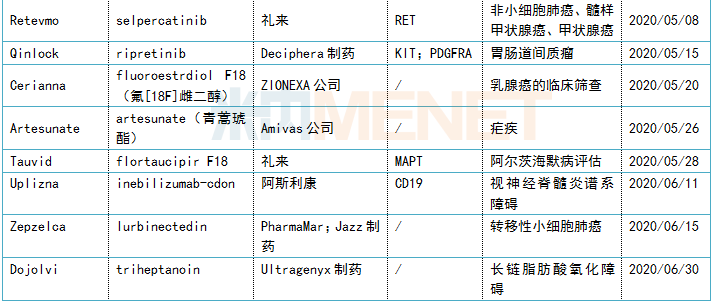
流水的创新药,铁打的抗肿瘤药
上半年获得批准的25款新药,分布在抗肿瘤和免疫调节剂、神经系统药物、消化系统及代谢药、心血管系统药物、感觉系统药物和抗寄生虫药、杀虫剂和驱虫剂等7个治疗领域中,排在首位的是抗肿瘤和免疫调节剂,占据获批新药总数的44%。
图1:上半年获批新药治疗领域分布
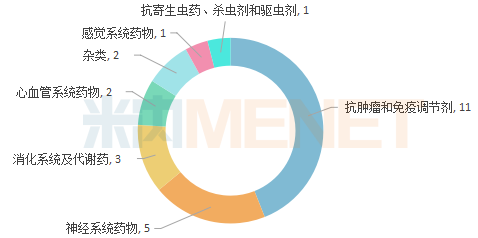
近年来,全球癌症发病率及死亡率持续上升,在此背景下,世界抗肿瘤药市场正在急速增长中,Evaluate Pharma数据显示,2020年全球肿瘤药市场规模预计超过1500亿美元。巨大的市场空间,让抗肿瘤市场成为了各药企巨头争夺的焦点。2020年上半年,抗肿瘤药热度依旧高居不下,FDA批准的抗肿瘤新药共11款,涉及胃肠道间质瘤、三阴乳腺癌、非小细胞肺癌、胆管癌等多种瘤种。值得一提的是,近两年火爆全球的抗体偶联药物(ADC)又有新突破,4月FDA批准了全球第四款ADC药物Trodelvy(sacituzumab govitecan-hziy)上市,用于治疗三阴性乳腺癌患者。
随着基因时代的到来,癌症机制获得到更深入的理解、同一瘤种可以被不断细化分类,抗肿瘤药物适应症范围会越来越精细,研发药企更倾向于先选择一种符合罕见病定义的适应症上市,利用“孤儿药”政策红利快速占领市场空间,再扩展适应症范围,K药的2014年通过黑色素瘤适应症上市再一路扩充适应症版图就是再好不过的例子。就2020年上半年来看,获批上市的11款抗肿瘤药物,其中有10款获得孤儿药资格认定,占比超过九成,充分证明这一策略在抗肿瘤领域的重要地位。
特别审批通道“多管齐下”推动创新
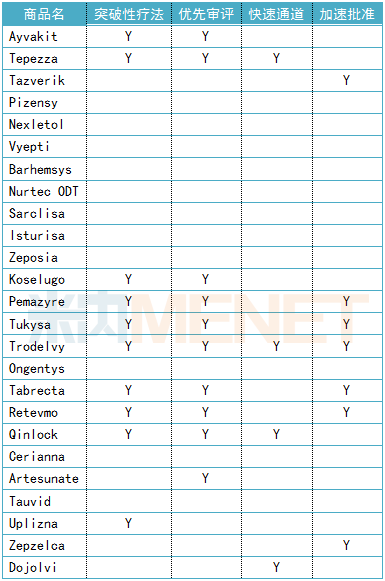
在不损害药物安全性和有效性标准的前提下,为了方便有重要治疗价值的药物尽快上市,FDA设置四条特别审批通道,即突破性疗法(Breakthrough Therapies)、优先审评(Priority Review)、快速通道(Fast Track)和加速批准(Accelerated Approval)。简单来说,以上四条特殊通道的药物在不同程度、不同阶段可以得到FDA专家介入指导,加快研发进度,或者在审评阶段缩短审评周期,尽早得到FDA答复。
2020年上半年,FDA使用了“多管齐下”的特别审批通道增强创新药开发和批准的速度和效率。在上半年获批的创新药中,40%获得突破性疗法认定,40%获得优先审评资格,16%获得快速通道资格,28%获得加速批准。总体来说,11款创新药(56%)至少获得FDA四大资格认定中的一种。
表2:25款新药特别审批通道总结
抗体,生物药市场当之无愧的“中流砥柱”
近年,生物药市场发展迅猛,已成为全球医药市场不可或缺的一部分。从全球各大制药巨头公布的2019年财报来看,2019年全球最畅销的10款药物中,6款为生物药,合计销售额约达615.7亿美元,在前十药物中占据62.8%,再一次验证了全球市场对于生物药的认可。
生物药市场又可细分为抗体、融合蛋白、EPO、G-CSF、促卵泡激素等的具体领域,其中,抗体药物凭借特异性强、副作用小等优势,加之临床研究的不断推进和商业化策略的不断完善,抗体药物各方面均日趋成熟,市场容量快速攀升,已然成为生物药最主要的品种,当属生物药市场的“中流砥柱”。
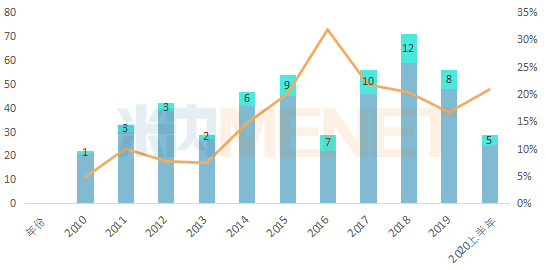
自2014年开始,抗体新药批准呈爆发式增长,2014至2019年6年间,共批准52款抗体新药。2020年上半年,FDA共计批准5款生物药,5个席位全由抗体药物承包,包括4款单抗(teprotumumab、eptinezumab、isatuximab、inebilizumab)、1款ADC药物(sacituzumab govitecan),可见抗体药物已经成为生物药新药领域的王牌,也是各大新药研发巨头竞相追逐的领域。
图2:FDA历年获批的新药及抗体新药
积极引进创新药,国内药企向创新转型迈进
近年来我国医药创新环境不断改善,一系列鼓励药品创新的监管政策落地实施,创新药纳入医保目录的路径加速拓宽,各类政府资金、大量社会资本投入到医药创新领域。与此同时,在一致性评价、带量采购政策下仿制药面临的降价压力加剧,在这种背景下,更多企业往医药创新方向寻找出路。其中,通过引进全球创新药快速布局国内市场,已经成为国内药企向创新转型迈进的一大武器。
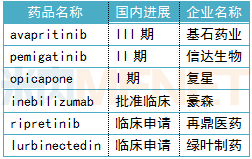
2020年上半年,FDA批准的25款创新药物中,已有6款新药由国内药企引进中国市场,信达生物、豪森、再鼎医药、绿叶制药、基石药业、复星分别拥有pemigatinib、inebilizumab、ripretinib、lurbinectedin、avapritinib、opicapone在中国开发和商业化的权利。
表3:6款已引进新药国内进展
他们,把这些新药引进国内
Avapritinib:由蓝图医药开发研发,于2020年1月获FDA批准上市,用于治疗携带血小板衍生生长因子受体α(PDGFRA)基因外显子18突变(包括PDGFRA D842V突变)的不可切除性或转移性胃肠道间质瘤(GIST)成人患者。这是全球首款被批准用于治疗GIST患者群体的精准疗法。对于四线治疗的PDGFRA外显子18突变(包括PDGFRA D842V突变)的不可切除或转移性GIST患者,对瑞戈非尼等常规药物都耐药,已经无药可治,Avapritinib有望为这类患者提供一个新的治疗选择。2018年6月,基石药业与蓝图医药达成独家合作及授权协议,推进包括avapritinib在内的三款药物的单药或联合治疗在中国大陆及香港、澳门和台湾地区的临床开发与商业化。
Pemigatinib:2020年4月,Incyte公司靶向抗癌药Pemazyre(pemigatinib)在美获批上市,用于治疗既往接受过治疗、采用FDA批准方法检测的具有FGFR2基因融合或其他重排且不可手术切除的局部晚期或转移性胆管癌成人患者。Pemazyre是首款获得批准用于治疗胆管癌的靶向药物。2018年末,信达生物和Incyte公司就Incyte的pemigatinib、itacitinib和parsaclisib三个临床阶段候选药物达成了战略合作,信达生物拥有以上3个药物在中国(包括香港/澳门、台湾地区)的开发和商业化权利。
Opicapone:Ongentys(Opicapone)同样在2020年4月获得FDA批准,作为左旋多巴/卡比多巴辅助治疗药物,治疗经历“关闭”期的帕金森病患者。Ongentys是首款获得FDA批准的可减少“OFF”期时间且不会引起运动障碍的儿茶酚氧位甲基转移酶(COMT)抑制剂。该药最早由BIAL Pharmaceuticals公司研究开发,2018年1月,复星医药以1800万美元从BIAL公司授权获得了opicapone在中国市场的独家权利。
Inebilizumab:2020年6月,阿斯利康子公司Viela Bio制药公司的抗 CD19 单抗Uplizna(inebilizumab-cdon)在美批准上市,用于治疗抗水通道蛋白-4(AQP4)抗体阳性的视神经脊髓炎系障碍(NMOSD)的成人患者。Uplizna是是全球第二款被批准用于治疗AQP4抗体阳性NMOSD患者的创新疗法。在那一个月前,豪森药业与Viela Bio达成了战略合作,前者拥有inebilizumab治疗NMOSD以及其他潜在的炎症/自身免疫和血液学恶性肿瘤适应症在中国开发和商业化的权利。
Ripretinib:2020年5月,Deciphera制药公司的Qinlock(ripretinib)获得FDA批准上市,用于治晚期胃肠道间质瘤(GIST)的四线治疗。该药是首款被FDA批准用于四线治疗胃肠道间质瘤的靶向药物。Qinlock适用于先前接受过包括伊马替尼、舒尼替尼、瑞戈非尼在内的3种或3种以上激酶抑制剂治疗的成人患者。2019年6月,再鼎医药与Deciphera制药公司达成独家授权协议,以推进Ripretinib在大中华区(中国大陆、香港、澳门和台湾)的开发和商业化。
Lurbinectedin:2020年6月,PharmaMar与Jazz制药公司合作研发的Zepzelca(lurbinectedin)获得美国FDA批准,用于二线治疗接受含铂类药物化疗期间或之后疾病进展的转移性小细胞肺癌(SCLC)患者。2019年4月,绿叶制药与PharmaMar达成授权研发合作协议,获得lurbinectedin在中国开发及商业化的独家权利,包括小细胞肺癌在内的所有适应症,并可要求PharmaMar进行该药物的技术转移,由绿叶制药在中国生产。
上一篇: 北京、海南、山东、辽宁等地制定短缺药品清单
下一篇: 七部门:杜绝医药统方 严禁医院指定配送企业和药店
热门文章排行
更多>>
- 联合国秘书长呼吁停止歧视自...
- 重庆居民慢性病自我管理组首...
- 医学期刊表现抢眼 我国学术...
- 2010年6个医学相关学科取得...
- 听障和脑瘫抢救性门诊费实现...
- 七部门联合检查 所有医疗机...
- 青岛联动机制智斗非法行医“...
- 湖北重点地方病防治“答卷”...
- 山西6月底前实现城镇医保市...
- 零差价冲击客源 单体药店或...
- 医学类毕业生就业冷热不均
- 医药职专就业:畅通“出口”...
- 上海五年内将对儿科、产科、...
- 硕士去绍兴就业 购房打6折
- 应届毕业生春季招聘进入倒计...
- 学历门槛成了就业拦路虎
- 县级医院发展势头猛 医疗人...
- 首批医疗监督大使给力民营医...
- 全球每年死产婴儿数降幅仅1....
- 卫生信息化发力 公私医院实...







